

来源:正解局
◆新冠病毒检测之战再次启示我们,关键技术,还是要掌握在自己手里。
早发现、早隔离、早治疗——这是中国抗击新冠病毒的经验。
早发现是前提,发现要靠检测,检测又离不开核酸检测试剂。
核酸检测试剂的成功研发与生产,无疑是抗击病毒的关键一战。
一度被欧美垄断的核酸检测,中国是如何成功突围的?
1. 检测试剂为何重要?
在武汉战疫初期,几乎每天的新闻都在报道武汉核酸检测试剂数量不够,不是每个人都能够得到检测。
也正因如此,李兰娟院士说“早发现、早诊断、早隔离、早治疗,目前在武汉还做不到,希望全国支持武汉”。
那么,核酸检测试剂为何备受瞩目?
核酸检测直接对标新冠病毒RNA的特异片段,利用荧光PCR技术,凭借指数级的复制,即便病毒载量低,也能成功检测出病患是否被感染。
核酸检测,是目前临床上进行病例确诊的“金标准”。
PCR技术 来源:必应
除了核酸检测,抗体检测也是临床上普遍使用的检测方法。但是,与核酸检测相比,抗体还有一定的局限性。
这是因为,病患产生IgM抗体一般需要一周的时间;而核酸检测是直接检测方法,只要患者体内病毒浓度达到一定范围就可以检测到。
所以,国内外的临床指南都通过核酸检测来验证病患是否已感染新型冠状病毒。

核酸检测试剂 来源:美疾控中心官网
核酸检验需要针对新型病毒开发特异性高的检测试剂,中国高效的检测试剂研发和生产能力为抗击疫情提供了强有力的支持。
1月23日10时,武汉封城。
1月26日,之江生物成为国内首个经药监局批准获得三类医疗器械证书的新型冠状病毒核酸试剂生产商。

之江生物新型冠状病毒2019-nCoV核酸检测试剂盒
随后,其他企业纷纷跟进。3月27日,国家药监局应急审批通过1个新冠病毒检测产品。
至此,中国的新冠病毒检测产品总数已达23个,包括核酸检测试剂15个和抗体检测试剂8个。
圣湘生物新型冠状病毒核酸检测试剂日均产能最高可达50万人份;达安基因3月19日在互动平台表示,公司新冠核酸检测试剂盒产品向市场累计供应超过500万人份。
政府官方数据,国内核酸检测试剂日产能近260万人份,抗体检测试剂日产能近100万人份,核酸试剂供给有力地保障疫情防控需求。
同时,“中国制造”的检测试剂,走出国门,走向世界。
欧洲疫情肆虐,对病毒检测的需求大幅度增加,核酸检测试剂陷入紧缺。在满足我国病毒检测需要的基础上,中国的检测试剂以各种渠道“走出去”。
中国向日本捐赠核酸检测试剂
中国不仅捐赠了一批又一批试剂,也已经向意大利、英国、荷兰等十余个国家销售。
2. 中国突围之路
核酸检测是体外诊断(IVD)重要分支,中国的起步很晚。
20世纪70年代末,随着改革开放的到来,中国体外诊断产业才开始发展。
国内陆续出现体外诊断试剂的生产厂家,但生产规模小而单一,大多数产品也仅限于零星的实验室研究使用,比如生物样本检测等。
相比之下,欧美等发达国家已经对快速发展的体外诊断产业实施制度监管。
国内的检测试剂市场一直被国外企业垄断,直到上世纪最后十年,国产的商品化成套试剂盒才逐渐进入临床。
进入新世纪后,中国的IVD产业迎来快速发展,又是如何突围的呢?
其一,国家长期对基础学科特别是生物研究的投入,为诊断试剂的开发提供了充足的智力支持。
2005-2016年,国家政策大力扶持生物医药产业的发展,重视对高端人才的培养,吸引了更多优秀的人才投身生物医药研究。研发机构人员数量由1577人增加至11494人。
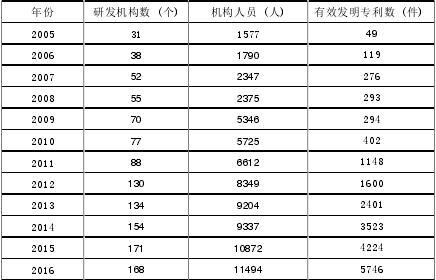
2005-2016年生物医药产业研发机构和专利数量
来源:中国高技术统计年鉴
其二,优厚的人才政策,吸引了大量海外人才归国,这些海外精英把检测技术带回国内。
湖南圣湘生物科技有限公司董事长戴立忠,早年赴美攻读硕、博学位,毕业后加入美国最大的核酸试剂公司Gen-Probe工作。
2008年,他回国创业,在他的带领下,团队研发出高精度乙肝定量PCR检测试剂,检测时间比国内同类产品缩短90%以上,灵敏度仍高出50倍至100倍,价格仅是国外同类产品的1/3左右。
在这次的新冠疫情中,圣湘也第一时间开发出荧光PCR法核酸检测试剂盒,顺利通过国家药监局审批,在临床上支援抗击疫情。

圣湘获批通告 图片来源:国家药监局官网
其三,国内高速发展的经济和日益规范的投资市场,为创新企业发展保障了资金支持。
2005-2016年中国生物医药产业技术研发经费支出中,技术改造经费支出最大。
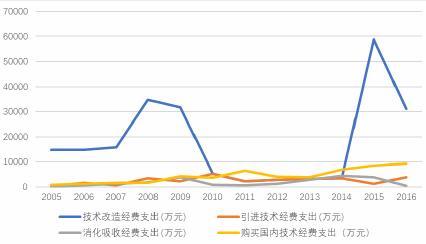
2005-2016年生物医药产业技术研发经费支出
来源:中国高技术统计年鉴
疾风知劲草,时势造英雄。
新冠病毒突袭而来,无疑给了中国企业一次展现核酸检测试剂研发能力的机会。
3. 美国先发,为何晚人一步?
作为后入场者,中国虽然奋力追赶,却还未跑赢欧美国家的医药巨头,IVD的全球市场仍然被欧美巨头把持。
世界体外检测产业呈现“4+X”的格局,以罗氏、西门子、雅培、贝克曼等为代表的前十大企业占据了全球80.7%的市场份额。
美国无疑是检测试剂的老大,排名前四的雅培、贝克曼等都是美国公司,世界排行前十的制药企业,也有6家属于美国。
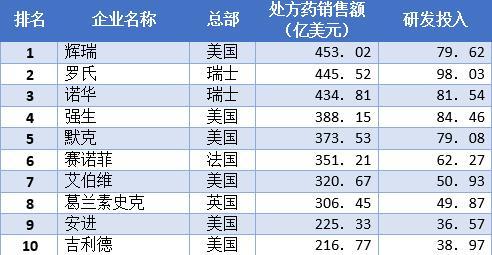
2019全球TOP10制药企业
让人好奇的是,美国为何在这次新冠疫情中落了下风呢?
首先,美国一线检测人员较少,成为最大短板。
3月5日,美国官方表示,已向全国发放110万份试剂。
3月11日的国会听证会上,该数据被打脸,美国疾控中心承认,本部门每天仅能检测300到350个样本。美国副总统彭斯也向媒体记者承认:
美国现有检测试剂不足,无法满足检测需求的预期增长。
3月18日,被问及“检测资源不足,为什么不少政界名人和社会名流却能优先接受检测”,特朗普回答道,“或许这就是人生吧。”

特朗普:这就是人生
其次,生物制剂的生产要求非常高,美国检测试剂的制造出现问题。
2月12日,美国疾控中心对媒体表示,部分实验室在检测试剂盒有效性的过程中报告了“一些问题”,导致部分实验室的检测出现“无效结果”。

美国试剂短缺
最后,体制僵硬,流程繁琐,审批过程过于复杂。
1月20日,美国用自行研发的试剂盒,成功检测出了第一例由武汉入境华盛顿州的输入型病例。然而,直到2月29日,美国食品药品监督管理局更新检测批准流程后,部分实验室才被允许自行生产检测试剂。
不可否认,美国的生物技术世界领先。在新冠病毒的检测却惨遭滑铁卢,说到底,还是政府的动员能力出了问题。
面对重大公共紧急事件,考验的不仅是科技实力,更是随机应变的动员能力。
新冠病毒检测之战再次启示我们,关键技术,还是要掌握在自己手里。
假设中国无法自主生产检测试剂,又将如何面对这场疫情?













































































